脑肿瘤分割算法研究
时间:2023-01-29 12:40:05 来源:天一资源网 本文已影响 人 
张士强 石 磊 程晓东
(内蒙古大学电子信息工程学院,呼和浩特 010021)
神经胶质瘤是最常见的原发性肿瘤,属于中枢神经系统肿瘤,并且由不同的子区域构成[1]。
神经胶质瘤的生长特性是对周围组织的浸润性生长,从脑组织内部向外呈指状深入破坏脑组织。
过去的20年,随着医学影像诊断技术及显微神经外科手术的技术的应用与进步,人们在神经胶质瘤的诊断和治疗方面取得了突破性的进展[2]。
CT 与核磁共振成像技术在胶质瘤诊断中占有重要的地位,核磁共振图像相比CT 成像更准确,影像更为清楚。
分子生物学概念的引入,帮助人们从神经胶质瘤的发病机制到不断更新的临床治疗手段做了大量的工作[3]。
在胶质瘤的临床治疗中,精准的对胶质瘤及周围组织进行分割,能够有效的提高胶质瘤的治疗效果,帮助神经胶质瘤患者的生命能够更好的延续下去,是所有神经外科医生的共同愿望。
图像分割作为计算机视觉领域中的一个重要分支,很多研究人员提出了很多分割算法。
Long等[4]基于传统的CNN 提出来的全卷积网络(FCN),实现了像素级的分类,并使用反卷积进行上采样,同时引入了跳跃连接来改善上采样粗糙的像素定位,形成了一种端到端的图像分割网络。Ronneberge 等[5]提出的UNet 网络,为医学图像分割打开了大门。
UNet 网络采用了新的特征融合方式,将特征在相同的通道中进行融合,这使得UNet 网络适用于超大图像的分割。
医学图像本身具有边界模糊,梯度复杂,包含较多的高分辨率信息的特点,分割的目标在医学图像中的分布具有规律性,通过低分辨率的信息就可以分辨图像中的语义,而UNet的下采样是一个从高分辨率(浅层特征)到低分辨率(深层特征)的过程,深层特征用于定位,浅层特征用于精准分割,因此UNet 网络在医学图像分割领域的表现十分出色。
在UNet 的基础上,周纵苇等[6]提出了UNet++图像分割网络,UNet++网络设计了全新密集的,嵌套的跳跃连接方式,同时引入了深度监督这一概念,结果表明相比于UNet 及wide UNet 取得了3.9 及3.4 点的IoU 增益。
黄惠民等[7]提出的UNet3+网络,使得U 形网络得到更好的发展,相比于UNet++网络,UNet3+重新设计了编码器和解码器之间的相互连接以及解码器之间的内部连接方式,以从全尺度捕获细粒度的细节和粗粒度的语义[8]。
UNet3+还加入了更全面的深度监督,但UNet3+网络仍然存在不足,UNet3+不能够从多尺度图像中探索足够的信息。
通过对UNet++的网络结构进行研究,改进了UNet++的网络结构,保留了UNet++中密集式的跳跃连接,这可以保证改进后的网络能够从大尺度的医学图像中获取更多的语义信息,同时引入了更全面的深度监督。
结果表明,相比于现有的分割网络,改进后的网络在神经胶质瘤分割任务中表现出更好的分割性能,这对于临床中神经胶质瘤的诊断能够提供很大的帮助。
1.1 实验数据
BraTS 2018 数据集与BraTS 2019 数据集是公开的神经胶质瘤数据集,脑肿瘤分割比赛是MICCAI所有比赛中参与人数最多,历史最为悠久的比赛,是一个很好的了解前沿分割算法平台[9]。
BraTS 训练数据集划分为HGG(高级别胶质瘤)和LGG(低级别胶质瘤)两部分。
BraTS 2018 包含285 例病人,其中HGG(高级别胶质瘤)包含210 个病例,LGG(低级别胶质瘤)包含75 个病例[10]。
相比于BraTS 2018 数据集,BraTS 2019 数据集在其基础上,新增了50 个病例,共335 个病例,其中HGG(高级别胶质瘤)新增了49 例,LGG(低级别胶质瘤)新增了1例。
此次研究将BraTS 2018 数据集作为训练集,BraTS 2019 数据集中新增的病例作为此次研究的测试集,每张图像的分辨率为240 像素×240 像素×155像素。
所有成像数据均由1 ~4 位评估者手动分割,其注释也由经验丰富的神经放射科医生批准。
所有提供的数据经过预处理后均被分发到同一解剖模板中,且通过相同的分辨率(1 mm3)与颅骨剖离[11]。
每个病例数据集包括4 种模态数据及1 张分割标签数据,都以NIFTI 格式存储。
4 种模态数据分别是:T1、T2、FLAIR、T1CE 图像。
分割的内容包括3 个部分:整个肿瘤(whole tumor,WT):增强肿瘤(enhancing tumor,ET);
肿瘤核心(tumor core,TC)。
本研究将在上述两个数据集进行实验,验证改进后的网络在该数据集的效果是否优于之前的网络。
1.2 数据处理
从数据集的特点来看,此次研究所使用的数据集具有4 个模态,需要分割的内容共包括3 个标签,因此该数据集是一个多模态多标签的数据集。
对于医学图像分割任务而言,单一的模态不足以保证肿瘤信息的完整性,而多模态的图像能够有效地互补,可以显著的提升分割的准确性,但这也大大增加了分割的难度。
为了有效地验证网络在该数据集中的性能表现,针对这样一个多模态多标签的数据集,结合了以下预处理方案。
标准化。
不同模态图像由于成像原理的不同,每一种模态图像的特征各有各的特点,最大的区别是图像对比度的不同。
为了后续将4 种模态的图像进行融合,生成训练数据,需要对数据集中的不同模态图像实行标准化,通过对离群值的界定从而实现了异常值的修正,这样的修改可以得到更理想的数据集。
裁剪。
研究的主要任务是从多模态的图像中分割具有多标签的神经胶质瘤,而黑色的图像背景对于神经外科医生来说会被直接忽略掉,医生的目光会全都聚焦在大脑组织区域,取包含胶质瘤的区域为ROI,大小为170×170×155。
切片。
数据集中的所有医学图像都是以NIFTI格式存储的三维数据,只有将这些三维数据切片成2D 数据,才能适应2D 网络[12]。
每张三维图像均包含155 张2D 切片,将切片后的4 种模态数据经过图像增强处理后再组合成多通道的图像,同时为了提高数据的均衡性,将切片后的图像中不含有脑组织区域的图像去除,最后组合成numpy 文件,组合后的图像的维度为(170,170,4)[13]。
图像增强。
UNet 的作者在细胞分割比赛中,就使用了大量的图像增强技术[14]。
图像增强的主要目的是突出图像中的目标,这并不会增加图像信息,但可以使目标更容易被识别[15]。
根据医学图像的特点,从数据集中图像的灰度图可以了解到,图像的灰度级主要分布在[150,240]之间,为增强图像对比度,对组合后的图像进行分段线性变换,经过多次的测试,将主要的灰度级拉伸到[120,250],其计算公式为
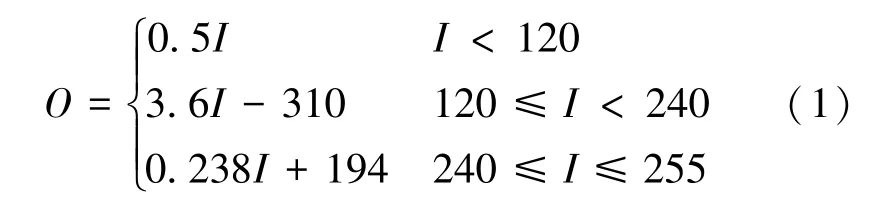
式中,I为输入图像,O为输出图像,经过对比度拉伸后的图像比原图能够更加清晰的看到更多的细节。
1.3 改进的UNet++网络
随着U 形网络结构在医学图像分割中应用越来越广泛,很多专家学者在此基础上提出了新的网络,UNet ++作为其中的一员,发表于2018年MICCAI 国际会议。
UNet++提出了一种嵌套,密集式的跳跃连接方式。
在本研究中,改进后的网络仍然保留了这一体系结构,这种密集式的体系结构可以有效的缩小编码器和解码器之间的语义缝隙,当编码器网络的高分辨率特征映射在逐渐增大时,该结构可以更有效地捕获前景对象的细粒度细节与解码器网络中相应的语义的特征映射融合,从而得到更好的分割结果[16]。
编码器与解码器结合的网络结构很早就被提出来,当时的主要任务是用来压缩图像和去噪。
下采样(down-sampling)的过程,可以增大输入图像的鲁棒性,降低过拟合的概率以及增加感受野的大小。
上采样(up-sampling)的过程就是将提取到的抽象的图像特征进行解码,再将解码后的特征整合为图像,得到分割结果[17]。
每一次下采样后的节点,还要再经过上采样与之前通道数相同的节点以短连接和跳跃连接的方式进行特征叠加,这种结构的优势是可以抓取不同层次的图像特征,再进行特征整合叠加,加入到更浅的UNet 结构中,但这种架构只能在相同通道数之间进行融合,并未利用多尺度的信息。
改进后的网络在解码器阶段不光融合了同尺度的语义,还融合了来自解码器上采样部分的多尺度语义信息,改进后的全尺度特征连接方式将融合全尺度下的细粒度信息及粗粒度信息[18]。图1 说明了改进后的网络结构。

图1 改进后的网络结构。
网络结构中间部分就是跳跃式的连接方式。
改进后的网络在解码器阶段设计了新的跳跃路径,并且为了加快网络的收敛速度,引入了深度监督Fig.1 Improved network structure diagram.The middle part of the network structure is the jumping connection mode.The improved network designs a new hop path in the decoder stage, and in order to speed up the convergence of the network, deep supervision is introduced
以x1.3为例具体介绍改进后的架构,如图2 所示。x0.0节点为输入图像,经过连续4 次最大池化下采样,来传递浅层的语义信息,当前池化后的节点进行解码上采样,在与之前的节点进行特征叠加。与UNet++相同,x1.3节点与当前通道数相同的节点进行融合,除此之外,改进后的结构还将x1.3与x4.0,x3.1进行跨通道的融合。
为了保证在融合时特征图的分辨率一致,需要借助双线性插值法对解码上采样中的x4.0与x3.1两个节点进行特征图分辨率的放大,如图所示,x4.0需要放大8 倍,x3.1需要放大4 倍,统一分辨率以后,就可以将浅层的精细信息与深层的语义进行融合。
在改进的网络中,选取的特征融合方式依然采用了UNet 式的通道维度拼接融合,融合后的特征图经过BN 层与ReLU 层后,生成了节点x1.3。
在形式上,具体的全尺度特征融合路径可以描述为:由xi,j表示的编码器输出特征映射堆栈计算为
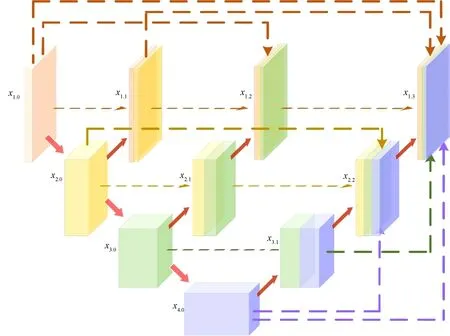
图2 以x1.3为例,改进后的网络结构Fig.2 Take x1.3 as an example, introduce the improved network structure in detail

式中,H表示特征融合机制,U表示上采样操作,[]表示通道维度拼接。
1.4 深度监督
为了使浅层网络能够得到有效地训练,以防神经网络训练梯度消失,加快收敛速度。
在改进的网络中,仍然加入了深度监督(deep supervision),从图1 中可以看出,每个解码器节点都有一个侧输出SUP,与GT(ground truth)进行比较。
实现深度监督的方法是将解码器的最后一层送入一个普通的1×1卷积中,以此用来监督每一层的输出。
同时为了获取良好的神经网络参数,网络定型过程中需要进行许多关于所用设置(超参数)的决策,为了防止过拟合,引入了早停法,当训练集上的loss 不再减小(即减小的程度小于某个阈值)次数超过规定数值时停止训练。
改进的网络中使用线性整流函数ReLU 作为激活函数,其公式如下:

式中,x表示来自上一层神经网络的输入。
准确度评判标准采用交并比IoU(intersection over union)。
损失函数为BCEWithLogitsLoss 函数,即二元交叉熵函数,它是将BCEloss 与Sigmoid 融合在一起,适用于多标签分类及分割任务,分别为

式中,c为分类任务中标签的数量,n为训练样本批次的数量。
1.5 评估标准
此次研究在BraTS 2018 数据集基础上,将预处理后的2D 数据进行训练,将BraTS 2019 数据集中作为测试集的50 例病例做同样的数据预处理操作。训练集中的数据包含18 923 个numpy 文件,每一个numpy 文件由4 种不同模态图像组成,测试集包含3 219 个numpy 文件,训练集与测试集的数据比例为6 ∶1。
实验中,最大迭代次数(epoch)为50,批量训练样本数目(batch_size)设置为10,早停(early stop)设置为20。
分割指标采用4 种,分别为:Dice相似度系数(Dice similarity coefficient,DSC),95%Hausdorff 表面距离(95%hausdorff surface distance),灵敏度(Sensitivity),阳性预测值(positive predictive value,PPV)分别计算如下:
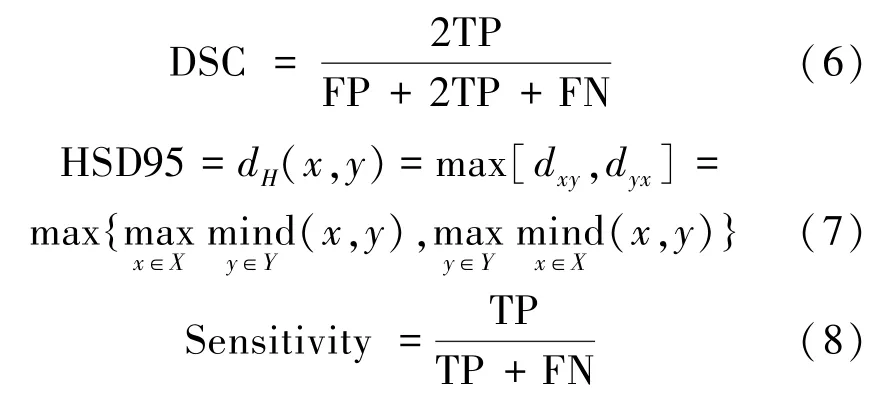

式中,TP(true positive)表示被判定为正样本,事实上也是正样本;
TN(true negative)表示被判定为负样本,事实上也是负样本;
FP(false positive)表示被判定为正样本,但事实上是负样本;
FN(false negative)表示被判定为负样本,但事实上是正样本。
上述指标将作为UNet,UNet++,UNet3+和改进后的网络在神经胶质瘤数据集的评判标准,来综合评价网络的分割性能。
针对研究中分割任务的多样性与复杂性,提出两套分割评价标准方案,第1 种方案是直接根据网络分割出的2D 切片,与测试集中的2D 标签进行对比进行预测,具体方法是把所有的切片的指标预测完以后,计算每个指标的平均值,但切片数据集中难免会存在像素信息不完善的图像,可能影响整体的指标,从而降低每个指标的平均值,无法对网络的分割性能作出相对正确的判断。
第2 种方案为了解决上一种方案存在的缺陷,提出将所有预测后的切片拼接为3D 图像,接下来对3D 图像进行整体指标均值计算,之前预处理的时候已经将无病变的切片去处理掉,在拼接时,按照原切片的数量(155)补齐相应的黑色背景区域即可。
网络预测生成的数据都为3D 的NIFTI 图像,可通过ITK-SNAP 查看重组后三维的分割图像[19]。
本研究在UNet,UNet++,UNet3+及改进后的网络的基础上,对处理后的数据进行分割测试,对于Dice 系数,95%Hausdorff 表面距离,Sensitivity,PPV这4 个指标,分割性能越好的网络,DSC,Sensitivity,PPV 指标值越大,而HSD95 指标越小。
表1 和表2分别描述了4 种神经网络在2D,3D 对比分割测试实验中得到的4 种评价指标值。
无论在2D 对比分割实验,还是在3D 对比分割实验中,改进后的网络在整体上相比于其他3 种分割网络有着更优异的表现。
在这两次对比分割实验中,3D 对比分割实验的指标值相比于2D 对比分割实验的指标值更高,改进后的网络4 种指标中绝大部分的指标值要优于其他3 种分割网络的指标值。

表1 BraTS 2018 和BraTS 2019 数据集各种算法的实验对比结果(2D)Tab.1 Experimental comparison results of various algorithms in BraTS 2018 and BraTS 2019 Datasets (2D)

表2 BraTS 2018 和BraTS 2019 数据集各种算法的实验对比结果(3D)Tab.2 Experimental comparison results of various algorithms in BraTS 2018 and BraTS 2019 Datasets (3D)
具体分析表格中的4 种指标,改进后的网络四种指标值相对于其他3 种分割网络,2D 对比分割实验结果中DSC 中的WT,ET,TC 平均提升了1.16%,3.5%,0.8%;
Sensitivity 指标中WT,ET,TC 平均提升了1.6%,1.8%,3.0%;
PPV 指标中WT,ET,TC平均提升了0.56%,1.10%,0.73%;
HSD95 指标中WT,ET,TC 平均缩短了0.041,0.268,0.743。
在此实验中,DSC 指标中的TC,PPV 指标中的WT,TC提升并不明显。
在3D 对比分割实验中,改进的网络比起前3 种分割网络的提升如下,DSC 指标中的WT,ET,TC 分别提升了1.28%,3.50%,3.55%;
Sensitivity 指标中WT,ET, TC 分别提升了1.15%,0.89%,9.41%;
PPV 指标中WT,ET 平均提升了0.47%,1.60%, 但是TC 平均降低了0.023%;
HSD95 指标中WT,ET,TC 平均分别降低了0.034,0.094,0.100。
将两次实验进行对比,3D 对比分割实验相比于2D 对比分割实验DSC 指标中WT,ET,TC 平均提升6.17%,2.40%,9.50%;
Sensitivity 指标中WT,TC 平均提升4.0%,3.4%,而ET 平均降低2.2%;
PPV 中的指标平均提升4.6%, 2.1%,11.7%,HSD95 指标WT,TC,ET 平均降低2.60,1.26,2.54。
每一种网络结构均按照其原本的标准结构进行了复现,实验证明UNet,UNet++,UNet3+均能表现出良好的分割表现。
从纵向对比4 种网络的分割性能,改进后的网络分割测试后的3 个标签中的4 种不同指标(共计12 个指标值),在2D 对比实验中有8 项取得了最好的分割结果,在3D 对比分割实验中有6 项取得了最好的分割效果。
通过计算每一种指标中3 个标签均值从横向进行对比改进后的网络,在4 个指标,有3 个指标的均值大于其他网络的指标平均值,在2D 对比实验中DSC 指标的均值为83.70%,Sensitivity 为88.40%,HSD95 为1.73,PPV 的表现并不是最优的,数值为84.96%;
在另一个3D 对比实验中,DSC 指标的均值为90.79%,Sensitivity 为91.23%,HSD95 为0.242,PPV 的表现同样不是最好的,数值为91.06%。
实验结果表明,改进的算法在整体上取得了更明显的优势,引入更全面的深度监督和多尺度特征融合能够有效地提高网络的分割能力。
图3 与图4 给出了4 种神经网络在神经胶质瘤数据集上两次对比分割结果的视觉对照,在这两次试验的视觉对比图中,每个网络相比原图像都表现出了很好的分割性能。
在2D 对比分割实验中,改进后的网络的分割结果相比于其他网络没有明显的碎片,3 个标签的分割结果与金标准的重叠度更高,在切片的方向上也没有像其他3 种网络的分割结果所出现明显的缺损。
图4 是将分割的3D 图像导入到ITK-SNAP 软件的显示结果,从图像中可以明显观察到神经胶质瘤的异质性,改进后的网络没有其他3 个网络较多的碎块,对ET 的分割没有像UNet3+那样出现过多的缺损,对WT 的分割没有出现UNet 和UNet++那样过多的碎块。
从整体的视觉效果上来看,改进后的网络的分割结果相比其他3种网络更接近金标准。

图3 2D 对比实验中各神经网络的分割结果的视觉对照﹝每列从上到下为选取的4 张病例的分割结果。
分割图像共含有4 个标签,标记为0,1,2,4。
黑色—背景区域,标记为标签0;
红色—非增强肿瘤(NET,nonenhancing tumor),标记为标签1;
绿色—水肿区域(ED,peritumoral edema),标记为标签2;
黄色—增强肿瘤(ET,enhancing tumor),标记为标签4。
按照数据集的规定,分割指标中所叙述的WT 共包含NET,ED,ET 三个部分,TC 包含NET,ET 两个部分,ET 即ET ﹞。
(a)UNet;
(b)UNet++;
(c)UNet3+;
(d)改进的网络;
(e)手动分割(金标准);
(f)待分割的原图Fig.3 Visual comparison of the segmentation results of each neural network in the 2D comparison experiment﹝The segmentation results of the four selected cases are from top to bottom.The segmented image contains a total of four labels, marked as 0,1,2,4.Black-background area, marked as label 0;
Red-non-enhancing tumor(NET,non-enhancing tumor),marked as label 1;
Green-edema area (ED, peritumoral edema), marked as label 2;
Yellow—enhancing tumor (ET), labeled as label 4.According to the regulations of the data set, the WT described in the segmentation index includes three parts: NET, ED, and ET, and TC includes two parts:NET and ET, and ET is ET ﹞.(a)UNet segmentation result;
(b)UNet++segmentation result;
(c)UNet3+segmentation result;
(d)Improved network segmentation result;
(e) Manual segmentation(Gold standard);
(f)Original image to be divided
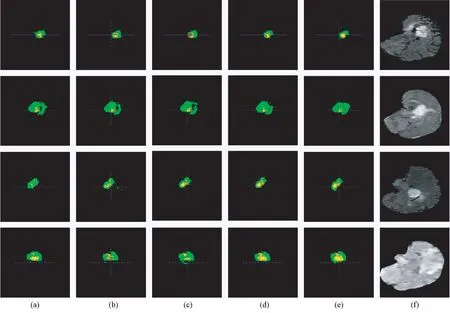
图4 3D 对比实验中各神经网络的分割结果的视觉对照﹝从上到下为选取的4 张病例的分割结果。
分割图像共含有4 个标签,标记为0,1,2,4。
黑色—背景区域,标记为标签0;
红色—非增强肿瘤(NET,non-enhancing tumor),标记为标签1;
绿色—水肿区域(ED,peritumoral edema),标记为标签2;
黄色—增强肿瘤(ET,enhancing tumor),标记为标签4。
按照数据集的规定,分割指标中所叙述的WT 共包含NET,ED,ET 三个部分,TC 包含NET,ET 两个部分,ET 即ET﹞。
(a)UNet 分割结果;
(b)UNet++分割结果;
(c)UNet3+分割结果;
(d)改进的网络分割结果;
(e) 手动分割(金标准);
(f)待分割的原图。Fig.4 Visual comparison of the segmentation results of each neural network in the 3D comparison experiment.﹝The segmentation results of the four selected cases are from top to bottom.The segmented image contains a total of four labels, marked as 0,1,2,4.Black-background area, marked as label 0;
Red-non-enhancing tumor(NET,non-enhancing tumor),marked as label 1;
Green-edema area (ED, peritumoral edema), marked as label 2;
Yellow—enhancing tumor (ET), labeled as label 4.According to the regulations of the data set, the WT described in the segmentation index includes three parts: NET, ED, and ET, and TC includes two parts:NET and ET, and ET is ET ﹞.(a)UNet segmentation result;
(b)UNet++segmentation result;
(c)UNet3+segmentation result;
(d)Improved network segmentation result;
(e) Manual segmentation(Gold standard);
(f)Original image to be divided
图5 依次给出了测试集IoU 曲线图,测试集Loss 曲线图,验证集IoU 曲线图,验证集Loss 曲线图。
可以看出,随着迭代次数的增加,4 种神经网络的曲线趋近平稳。
其中改进后的网络梯度下降更快,损失值和交并比在迭代次数达到最大时,在4 种网络中的表现最好,这也为改进后的网络在之前的表1,表2 的两次对比分割实验中的取得最好的指标值以及在两次对比分割实验结果的视觉对照中能够实现与金分割标准更高的重合度提供了证据。在(c),(d)两图中可以明显的看到UNet3+的曲线出现了一次严重的震荡,认为出现震荡的原因可能是当模型刚好拟合数据集时,继续强迫模型拟合过程中若存在不理想的标签数据就会破坏它的全局结构;
另一种原因可能是UNet3+的分类引导模块在分割测试时将包含肿瘤信息较少的图像错误的去除,这两点原因都可能导致UNet3+在BraTS 数据集上的分割性能表现较差。

图5 4 种神经网络交并比与损失值对比。
(a)测试集IoU 曲线;
(b) 测试集Loss 曲线;
(c) 验证集IoU 曲线;
(b) 验证集曲线Fig.5 Contrast graph of IoU and loss value of 4 kinds of neural networks.(a) IoU graph showing the test set;
(b) Loss graph showing the test set;
(c) IoU graph showing the validation set;
(d) Loss graph showing the validation set
为了实验的公平性,网络参数设置经过反复的测试,同时兼顾过拟合与欠拟合,利用早停法寻求最佳的epoch。
在实验环境的限制下,同时保证梯度下降的速度,学习率初始值设置为0.003。
本研究在基于Python 3.6 的pytorch 1.7 框架下进行神经网络的搭建,实验环境是单块显存空间为12 GB的NIVIDA GTX1080TI GPU。
在脑肿瘤分割挑战赛历年的最优研究方法中,如Zikic 等[20]提出一种采用AlexNet 网络4 输入通道的2D 脑肿瘤分割网络,这种单网络的分割结构的训练速度更快。
Pereira 等[21]使用了经典的VGGNet 网络,通过使用更小的卷积核进一步减少网络训练的参数量,但同时保持了较高水准的分割性能,但是不论是AlexNet 还是VGGNet 网络,仍然是单网络分割方法,无法有效的捕捉多模态数据集中复杂的上下文特征,AlexNet 方法在BraTS 2013数据集中的DSC 指标为分别为WT:0.84,ET:0.69,TC:0.74。
Havaei 等[22]构建了一种双路径的2D CNN 多网络脑肿瘤分割方法,双路径包括局部和全部两部分,该网络增加了图像特征表达能力,双路径可以保证网络可以获得全局和局部的信息,该方法在BraTS 2013 数据集中的DSC 指标分别为WT:0.88,ET:0.77,TC:0.83。
Soltaninejad 等[23]将卷积神经网络与传统算法进行结合,利用卷积神经网络进行特征提取,使用传统算法中的RF 滤波器进行图像分割,该方法能够有效降低分割误报,在BraTS 2015 数据集中DSC 指标分别为WT:0.88,ET:0.73,TC:0.80。
基于卷积神经网络的脑肿瘤分割方法使得深度网络得到充分的训练,但是依然存在预测标签时分割效率低,空间连续性差和训练过程复杂等问题[24]。
本研究基于UNet++全卷积网络的脑肿瘤分割方法使用端对端方式实现了语义级的密集预测,避免了使用图像块方式带来的重复存储和卷积计算问题,在获得有效分割精度同时也明显提高了脑肿瘤分割的效率,并且保留跳跃式的尺度融合方法保证可以从大图像中获取更多的像素信息,在BraTS 2018 和BraTS 2019 数据集上获得了先进的性能。通过表1 和表2 这两次对比分割实验中的分割指标可以看出,改进后的网络在4 个分割指标上的提升都是真实且明确有效的。
在两次对比分割实验中,PPV 的指标均值都不是最优的,排在第2 位,且改进的网络的指标值在表1 中有4 项指标值非最高,在表2 中有6 项指标值非最高,但是这些分割指标均值仍然高于其他部分分割网络的同指标均值,且通过图3,图4 可以清晰地看到,改进的网络在BRATS 的脑胶质瘤3 个标签WT,ET,TC 上,分割区域和标准标注的目标区域在空间中有着更好的重合度;
通过指标DSC,Sensitivity,HSD95 的对比,也明确了引入多尺度特征融合方案的合理性。
从图4的3D 视觉对比中可以看出,由于感受野相对较小,改进的网络倾向于将绿色水肿区域和增强肿瘤核心误认为是大脑周围组织,相比于手动分割标准,分割的结果出现了缺损,这与表1,表2 中PPV 的WT,ET 指标较低一致。
改进的网络相比于UNet,UNet++,的视觉对照,UNet 与UNet++的分割结果出现了较多的碎块和空洞,同样过多的缺口和缺损在改进的网络中并没有出现,改进后的网络同时兼顾大尺度图像输入与输出,在结果中减轻了前述的缺损,其分割结果相比前两者在区域轮廓中体现出更好的刻画。
本研究中仍然存在一些不足。
首先,要确定一个病灶一般情况下是需要通过复杂的整合判断得到的,单一图像的标注可能未必正当,不同模态的医学图像包含的信息侧重点不同,这可以保证训练出更强大的网络,显著提高分割精度,但也使得整个样本集显得十分庞大,会直接导致训练速度缓慢[25]。
其次,虽然改进后的网络融入了全尺度特征融合机制,但这是以网络训练参数为代价的,更多通道数的加入,使训练得到的维度特征很大,此时如果训练集的样本数量较少,将会产生严重的过拟合现象,而这两种情况无疑都会加大网络的训练难度。
希望在今后的工作中,既要高效的设计训练模型,还是要结合数据特点(如待分割对象的尺寸范围、2D 还是3D 等)进行网络设计,设计更加合理的图像预处理操作进而增强目标特征,采用更好的特征提取模块,以此来代替中间复杂的跳跃式的连接结构,在减少神经网络参数的同时保证分割精度的提升。
为了进一步提升脑肿瘤分割的准确性,本研究在UNet++分割网络的基础上,对其进行了改进,保留UNet++原有的跳跃式的连接方式,引入了多尺度的跳跃连接,形成了全尺度的分割网络,充分利用来自编码器与解码器不同层次的语义特征,最后在解码器阶段引入了深度监督,使得网络能够得到更充分的训练。
本研究在BraTS 2018 与BraTS 2019 公开的神经胶质瘤数据集上进行测试,同时与UNet,UNet ++,UNet3+的分割性能进行对比,改进的网络在4 种分割指标上取得了最好的结果,这充分证明了改进方案的正确性。
在临床应用中对脑肿瘤结构精准的分割将有助于准确测量相关疾病诊断的关键指标,帮助神经外科医生做出决定性的考量。
猜你喜欢 胶质瘤模态标签 长链非编码RNA在胶质瘤中的研究进展临床神经外科杂志(2022年6期)2022-11-14成人高级别脑胶质瘤术后复发相关因素分析中国现代医生(2022年19期)2022-08-25联合仿真在某车型LGF/PP尾门模态仿真上的应用汽车实用技术(2022年10期)2022-06-09多模态超声监测DBD移植肾的临床应用昆明医科大学学报(2022年3期)2022-04-19POU3F2在胶质瘤中的表达及其临床意义临床外科杂志(2022年2期)2022-03-23跨模态通信理论及关键技术初探中国传媒大学学报(自然科学版)(2021年1期)2021-06-09BFAR 在胶质瘤中的表达及其与胶质瘤预后的关系医学信息(2021年7期)2021-04-18不害怕撕掉标签的人,都活出了真正的漂亮海峡姐妹(2018年3期)2018-05-09让衣柜摆脱“杂乱无章”的标签Coco薇(2015年11期)2015-11-09科学家的标签少儿科学周刊·少年版(2015年2期)2015-07-07 相关关键词: 操作系统内存分配算法 程序算法描述流程图 银行家算法程序流程图 蚁群算法流程图 预算法实施管理条例









